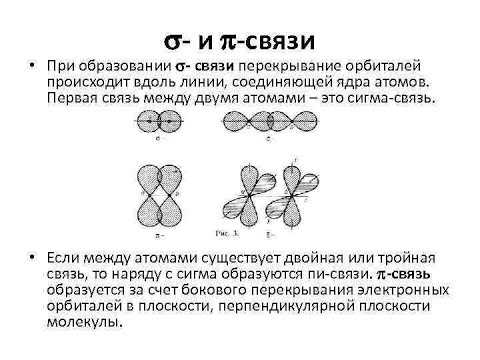

Связь сигма и связь пи являются основными типами химических связей, которые определяют структуру и свойства молекул. Обе связи играют важную роль в многочисленных химических реакциях и взаимодействиях веществ. Однако, связь сигма и связь пи различаются по своим уникальным характеристикам и методам образования.
Связь сигма представляет собой одинарную химическую связь, в которой электронная плотность между атомами ядра в основном концентрируется в направлении между ядрами. Связь сигма образуется при перекрытии волновых функций атомов путем наложения s-орбиталей или сп3-гибридизированных орбиталей. Она обладает высокой симметрией и стабильностью и является наиболее прочной из всех химических связей.
С другой стороны, связь пи представляет собой слабую, двойную или тройную связь, образованную при перекрытии п-орбиталей атомов. Связь пи имеет необычную форму, в которой электронные облака находятся над и под плоскостью, проходящей через ядра атомов. Она менее стабильна и менее прочна, чем связь сигма, но придает молекуле большую гибкость и возможность проводить электрический ток.
В целом, связь сигма и связь пи являются важными элементами химических связей и влияют на химические и физические свойства молекул. Их различия в структуре и характере образования открывают возможность для разнообразных реакций и взаимодействий, которые определяют широкий спектр химической науки и технологий.
Определение связи сигма
Связь сигма образуется путем накладывания двух орбиталей – одной с атома, которому принадлежит эта орбиталь, и другой с атома, который входит в образуемую связь. В этом случае сохраняется полная симметрия между данными орбиталями. Это различает связь сигма от связи пи, в которой происходит наложение плоскостных орбиталей, что приводит к образованию двух областей незаполненности над и под плоскостью молекулы.
Таким образом, связь сигма имеет линейную симметрию и сильное перекрытие орбиталей, что обусловливает ее прочность и стабильность. Она формируется в основном между s- и p-орбиталями, а также между двумя p-орбиталями, и может быть одиночной, двойной или тройной. Связь сигма играет важную роль в химии органических и неорганических соединений, определяя их структуру и свойства.
Определение связи пи
Основное отличие связи пи от связи сигма заключается в том, что пи-связь является более слабой и менее направленной, чем сигма-связь. В молекулярных системах, связь пи обычно формируют неспаренные электроны, которые находятся в пи-орбиталях. Связь пи может быть либо одно-, либо двухсторонней.
Односторонняя пи-связь образуется, когда пи-электроны перекрываются только между двумя атомами. При этом, плоскость перекрытия пи-орбиталей может быть любой, но наиболее распространенной является плоскость, параллельная плоскости, проходящей через ядра атомов и сигма-связь. В двухсторонней пи-связи перекрывание пи-электронных облаков возникает между несколькими атомами.
Важно отметить, что связь пи играет важную роль в определении химических и физических свойств соединений. Связь пи может влиять на способность молекулы к конгломерации, образованию кристаллических структур, а также на химическую активность и реакционную способность соединения.
Геометрическая структура связей
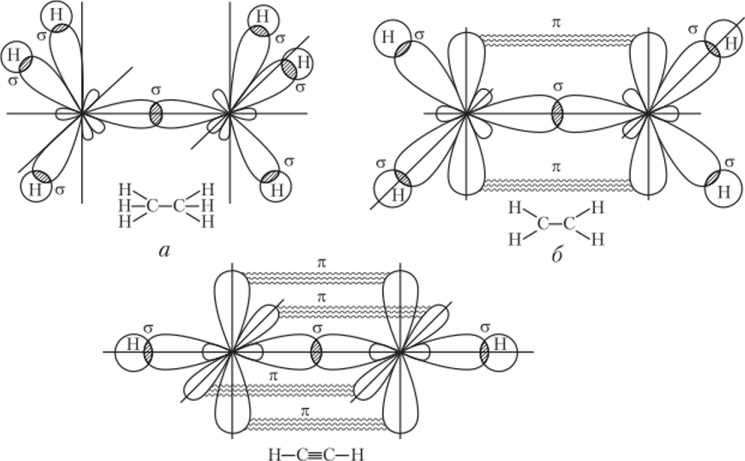

Существует два основных типа связей: сигма и пи. Сигма-связь образуется при перекрытии атомных орбиталей, расположенных вдоль оси соединения атомов. Пи-связь формируется при перекрытии плоских орбиталей, ориентированных перпендикулярно к оси соединения.
Геометрическая структура связей в молекуле определяется взаимным расположением атомов и связей между ними. Сигма-связи часто принимают линейную конфигурацию, так как орбитали перекрываются на оси соединения. Пи-связи могут быть прекрасными кандидатами для образования двойных или тройных связей, так как могут быть ориентированы параллельно оси соединения и дополнительно укреплять связи.
Характеристики связи сигма
Основные характеристики связи сигма:
- Прямолинейность: Существование связи сигма происходит в прямолинейном направлении между двумя атомами, что отличает ее от связи пи, которая может быть распределена над и под плоскостью связующих атомных орбиталей.
- Симметричность: Связь сигма считается симметричной, так как электроны связи равномерно распределены между двумя связанными атомами и образуют область высокой плотности электронов. Это позволяет связи сигма быть более устойчивыми.
- Более прочная связь: Связь сигма обладает более высокой энергией и более прочной связью, по сравнению с связью пи. Это связано с тем, что связи сигма образуются в основном из s- и p-орбиталей, тогда как связи пи образуются из p-орбиталей.
- Большая длина связи: Связь сигма имеет большую длину, чем связь пи. Это связано с тем, что связи сигма обладают большей вытянутостью из-за прямолинейной структуры, в то время как связи пи обычно гибкие и способны к более сильным деформациям.
Характеристики связи пи
1. Независимость от направления: Связь пи не имеет определенного направления, что отличает ее от связи сигма. Так как электроны в пи-орбиталях могут перемещаться по широкому диапазону плоскостей, связь пи устойчива к вращению молекулы вокруг своей оси.
2. Более слабое силовое взаимодействие: В связи пи энергия взаимодействия между атомами ниже, чем в связи сигма. Это связано с тем, что пи-орбитали располагаются выше и ниже плоскости атомных ядер, поэтому электроны в пи-связи находятся дальше от ядер и слабее притягиваются к ним.
3. Поперечность связи: Связь пи поперечна по отношению к оси между связанными атомами. Это означает, что связь пи не проходит между атомами, а окружает их сбоку. Поэтому, когда две плоские пи-орбитали перекрываются, образуется область с общими электронами, которая формирует связь пи.
Сравнение связи сигма и связи пи
Связь сигма:
- Связь сигма (σ-связь) образуется при наложении орбиталей вдоль оси между двумя атомами.
- Она является самой сильной из всех ковалентных связей и обычно можно найти в начальной, устойчивой стадии образования молекулы.
- Символически обозначается буквой σ.
- Связь сигма может быть образована между атомами одного или разных элементов.
Связь пи:
- Связь пи (π-связь) образуется при наложении плоских орбиталей параллельно между двумя атомами.
- Она является более слабой и менее распространенной, чем связь сигма, и обычно образуется после образования связи сигма.
- Символически обозначается буквой π.
- Связи пи обычно встречаются в двойных и тройных связях, где они обеспечивают дополнительную стабилизацию молекулы и повышают ее реакционную активность.
В целом, связь сигма является более прямой и стабильной, в то время как связь пи обеспечивает гибкость и молекулярное движение. Оба типа связей играют важную роль в химических реакциях и определяют структуру и свойства органических молекул.
Короткое описание
Сравнение связи сигма и связи пи является ключевой темой в химической физике. Связь сигма (σ) является более сильной и более энергетически низкой, а также симметричной по отношению к осям молекулы. В то время как связь пи (π) является слабее, более энергетически высокой и симметричной только относительно оси молекулы. Обе связи играют важную роль в формировании и стабилизации молекул, и их взаимодействие может сильно влиять на свойства и реакционную активность соединений.
Вопрос-ответ:
Чем отличается связь сигма от связи пи?
Связь сигма (σ) представляет собой сигма-связь, которая образуется между атомами одного и того же элемента или разных элементов. Она является самой прочной и наиболее стабильной химической связью. Связь пи (π) образуется только между атомами разных элементов и является слабее и менее стабильной, чем связь сигма.
Что такое связь сигма?
Связь сигма (σ) — это химическая связь, образующаяся между атомами одного и того же элемента или разных элементов. Она является самой прочной и наиболее стабильной химической связью.
Что такое связь пи?
Связь пи (π) — это химическая связь, образующаяся между атомами разных элементов. Она является слабее и менее стабильной, чем связь сигма. Связь пи образуется в результате перекрытия π-орбиталей атомов.
Какова структура связи сигма?
Связь сигма образуется путем перекрытия s- или p-орбиталей атомов. Они могут быть направлены вдоль оси между атомами, образуя прямую связь сигма. Прямая сигма-связь обладает наибольшей прочностью и стабильностью.
Какова структура связи пи?
Связь пи образуется путем перекрытия π-орбиталей атомов. Они могут быть направлены по бокам оси, перпендикулярно к прямой связи сигма, и образуют две связи пи — сигма. Связь пи слабее и менее стабильна, чем связь сигма.
Как можно сравнить связь сигма и связь пи?
Связь сигма (σ) и связь пи (π) являются двумя разными типами химических связей. Связь сигма обозначает однонаправленную связь, которая образуется из-за перекрытия двух атомных орбиталей, создавая радиально симметричную область в пространстве между атомами. В то же время, связь пи возникает при перекрытии плоских п орбиталей, образуя область симметричного распределения электронной плотности над и под плоскостью молекулы. Таким образом, связь сигма является более сильной и более направленной, в то время как связь пи является слабой и распределенной по большей площади.
Какие атомы могут образовать связь сигма и связь пи?
Связь сигма может образовываться между атомами, имеющими гибридизованные или не гибридизованные орбитали, независимо от их электронной конфигурации. Связь пи образуется, когда существуют п орбитали или зона перекрытия плоских π-орбиталей участвующих атомов. Таким образом, связь пи чаще образуется между атомами, содержащими электроотрицательные элементы или атомы, содержащие плоские или плоско-плоские орбитали.
